来源:医药魔方 | 2023-01-13 17:49:54 |
 【资料图】
【资料图】
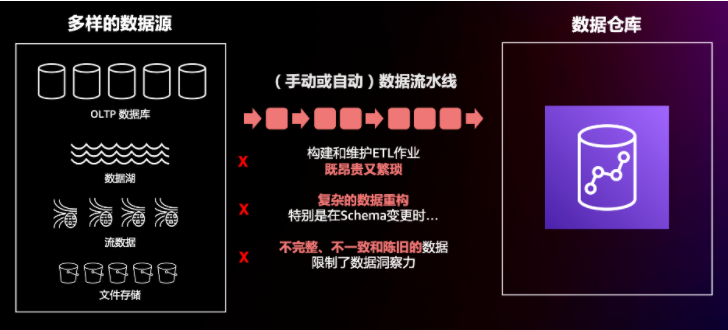
Krystal Biotech宣布,FDA在收到其于2022年12月20日提交的制造信息文件后,决定将B-VEC用于治疗营养不良性大疱性表皮松解症的生物制品许可申请(BLA)的PDUFA日期推迟至2023年5月19日,并建议说明书标签讨论不迟于2023年4月20日。
Krystal Biotech提交的制造信息文件包括有关制造过程的浓缩步骤中更换的硬件元件(不影响加工参数或产品接触材料)的附加信息以及支持证明该元件可用的可比性数据。
在2022年12月15日举行的BLA后期周期审查会议上,FDA表示不会召开B-VEC的咨询委员会会议,且B-VEC的BLA不需要提供风险评估和缓解策略(REMS,要求某些存在严重安全问题的药物提供的一项药品安全计划,以帮助确保药品的获益大于风险)。
营养不良性大疱性表皮松解症(DEB)是一种罕见且严重的单基因遗传性皮肤病,由负责编码VII型蛋白质胶原蛋白(COL7)的COL7A1基因发生一个或多个突变引起。这种突变会导致皮肤缺少将真皮(皮肤内层)与表皮(皮肤外层)固定在一起的基底膜结构,使得患者的皮肤和粘膜组织极度脆弱,轻微摩擦或创伤都会引起水疱和撕裂。DEB患者的伤口通常无法完全愈合,进一步导致皮肤感染和纤维化,后者可能使手指和脚趾融合,并最终增加发展为侵袭性鳞状细胞癌的风险,严重时可能致命。目前全球尚无针对性疗法获批。
B-VEC是一种基于单纯疱疹病毒1型(HSV-1)的局部外用基因疗法,旨在通过直接应用于伤口递送COL7A1基因来恢复正常COL7蛋白的表达。
B-CEC的作用机制(来源:Krystal Biotech官网)
Krystal Biotech董事长兼首席执行官Krish S. Krishnan说:“虽然我们对这一信息变动被视为一项重大修正感到失望,但我们一直在努力与FDA合作,因为它完成了对B-VEC的BLA的审查。我们将继续进行商业化准备工作,并争取在B-VEC获得批准后尽快为DEB患者提供药物。“

2023-01-13 16:46:40

2023-01-13 16:59:42

2023-01-13 16:38:42

2023-01-13 15:44:56

2023-01-13 15:42:14

2023-01-13 14:51:10

2023-01-13 14:50:14

2023-01-13 14:49:38

2023-01-13 14:49:24

2023-01-13 14:48:19

2023-01-13 14:46:05

2023-01-13 14:45:45

2023-01-13 14:43:20

2023-01-13 14:41:08

2023-01-13 14:40:11

2023-01-13 14:37:07

2023-01-13 14:31:57

2023-01-13 14:28:08

2023-01-13 14:21:51

2023-01-13 14:12:10

2023-01-13 14:12:08

2023-01-13 14:11:25

2023-01-13 14:07:54

2023-01-13 14:01:41

2023-01-13 14:00:45

2023-01-13 13:59:58

2023-01-13 13:58:49

2023-01-13 13:57:57

2023-01-13 13:57:06

2023-01-13 13:51:58

2023-01-13 13:51:12

2023-01-13 13:48:49

2023-01-13 13:45:22

2023-01-13 13:44:28

2023-01-13 13:43:22

2023-01-13 13:42:48

2023-01-13 13:41:14

2023-01-13 13:40:33

2023-01-13 13:40:18

2023-01-13 13:38:21

2023-01-13 13:38:19

2023-01-13 13:37:17

2023-01-13 13:36:44

2023-01-13 13:35:18

2023-01-13 13:35:06

2023-01-13 13:34:10

2023-01-13 13:30:36

2023-01-13 13:30:16

2023-01-13 13:28:02

2023-01-13 12:30:41

2023-01-13 12:09:36

2023-01-13 12:09:18

2023-01-13 12:01:45

2023-01-13 11:58:26

2023-01-13 11:51:45

2023-01-13 11:51:18

2023-01-13 11:49:14

2023-01-13 11:45:55

2023-01-13 11:44:27

2023-01-13 11:38:39

2023-01-13 11:38:21

2023-01-13 11:38:14

2023-01-13 11:37:25

2023-01-13 11:35:01

2023-01-13 11:32:44

2023-01-13 11:31:27

2023-01-13 11:27:54

2023-01-13 11:19:58

2023-01-13 11:15:24

2023-01-13 11:06:40

2023-01-13 11:02:44

2023-01-13 10:56:59

2023-01-13 10:55:00

2023-01-13 10:53:33

2023-01-13 10:53:13

2023-01-13 10:50:37

2023-01-13 10:44:37
2023-01-13 10:42:24

2023-01-13 10:42:24

2023-01-13 10:41:16

2023-01-13 10:41:01

2023-01-13 10:40:58

2023-01-13 10:39:21

2023-01-13 10:37:50

2023-01-13 10:37:03

2023-01-13 10:35:23

2023-01-13 10:33:24

2023-01-13 10:32:28

2023-01-13 10:31:42

2023-01-13 10:31:25

2023-01-13 10:21:39

2023-01-13 10:18:38

2023-01-13 10:07:24

2023-01-13 10:04:26

2023-01-13 09:59:31

2023-01-13 09:59:05

2023-01-13 09:53:25

2023-01-13 09:52:46
2023-01-13 09:51:46

2023-01-13 09:51:13
2023-01-13 09:50:48

2023-01-13 09:49:41

2023-01-13 09:49:24

2023-01-13 09:49:03

2023-01-13 09:47:00
